Om QdengaTM
QdengaTM er understøttet af et robust klinisk udviklingsprogram, der omfatter 19 fase 1-, 2- og 3-studier, 28.175 deltagere, 88 forsøgscentre og 13 lande 5-22

QdengaTM er indiceret til forebyggelse af denguefeber forårsaget af enhver af de fire denguevirus serotyper hos personer i alderen 4 år og derover 1
Studiedesign
TIDES (Tetravalent Immunization against Dengue Efficacy Study): Studie i virkningen af tetravalent immunisering mod denguefeber hos raske børn 2,3
- TIDES er et multinationalt, dobbeltblindet, randomiseret, placebokontrolleret fase 3-studie til vurdering af virkningen, sikkerheden og immunogeniciteten ved QdengaTM mod denguefeber, med fortsat langtidsopfølgning af deltagerne 1-3
- Samlet set har 20.099 raske deltagere i alderen 4-16 år fra 8 lande med endemisk dengue fået mindst én dosis af vaccinen eller placebo 2,3
- Brasilien, Colombia, Den Dominikanske Republik, Nicaragua, Panama, Filippinerne, Sri Lanka og Thailand
- Balanceret rekruttering mellem Asien-Stillehavsområdet (46,5%) og Latinamerika (53,5%)
- 91% af deltagerne gennemførte hele TIDES-studiet med ugentlige opfølgninger igennem hele studiets varighed på 4,5 år. 1,4
- Både dengue-naive og tidligere eksponerede individer er inkluderet i TIDES 2,3
- Ved baseline var 27,7% af forsøgsdeltagerne seronegative for alle fire denguevirus serotyper
- Eksklusionskriterierne omfattede febril sygdom ved baseline, nedsat/ændret immunforsvar, overfølsomhed over for en eller flere vaccinekomponenter, graviditet/amning, tidligere modtagelse af denguevaccine og andre protokolafvigelser iht. studiets kriterier 2,3
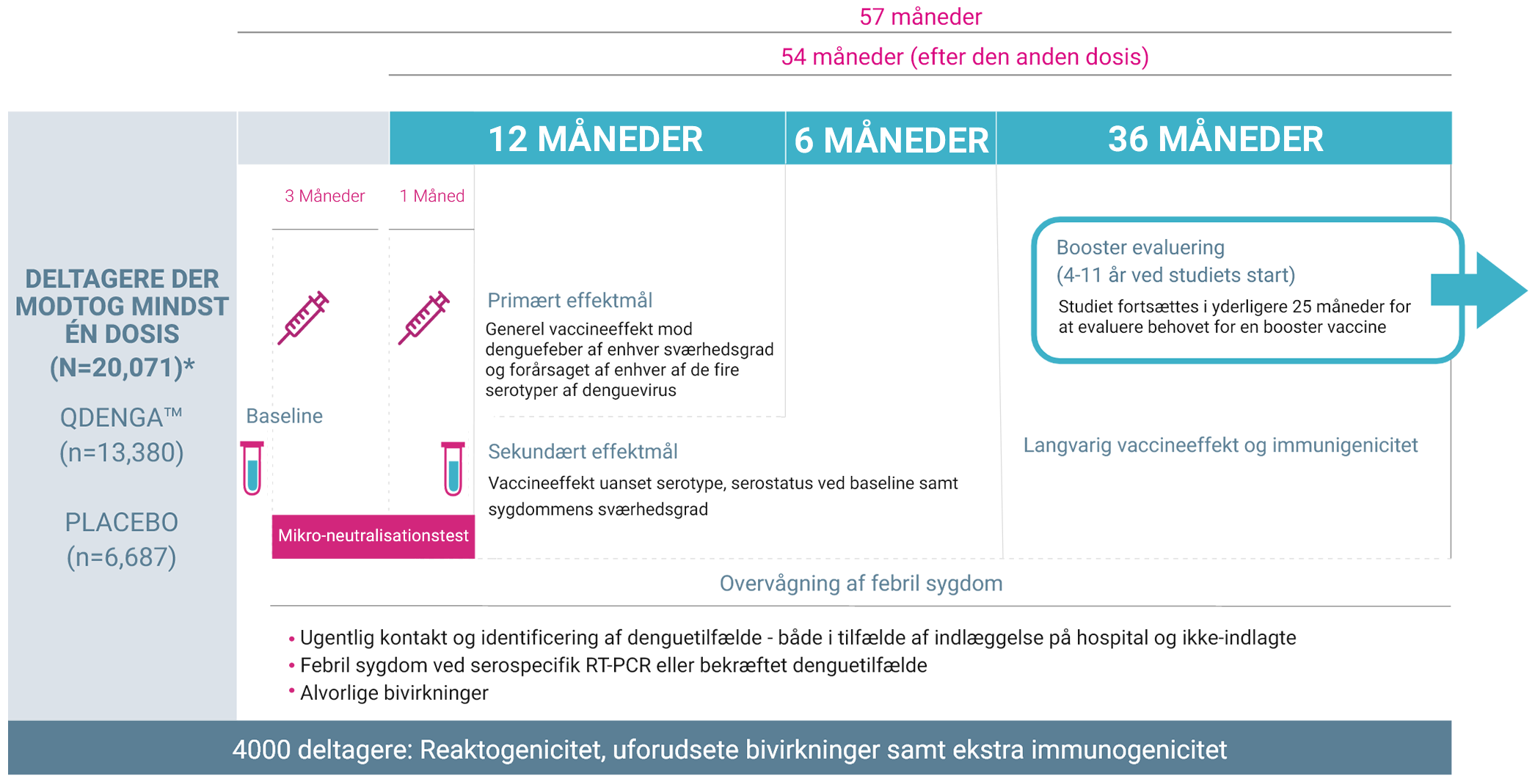

*Én dosis på 0,5 ml QdengaTM indeholdt ca. 3,6, 4,0, 4,6 og 5,1 log10 plaque-dannende enheder af hhv. DENV-1-, DENV-2-, DENV-3- og DENV-4-stammer, mens placebo var 0,5 ml saltvand. Fire deltagere fik både vaccine og placebo på grund af administrative fejl; disse deltagere er ikke medregnet i totalen 2
Tilpasset fra: Biswal et al. (2019); Biswal et al. (2020) 2,3
Effekt
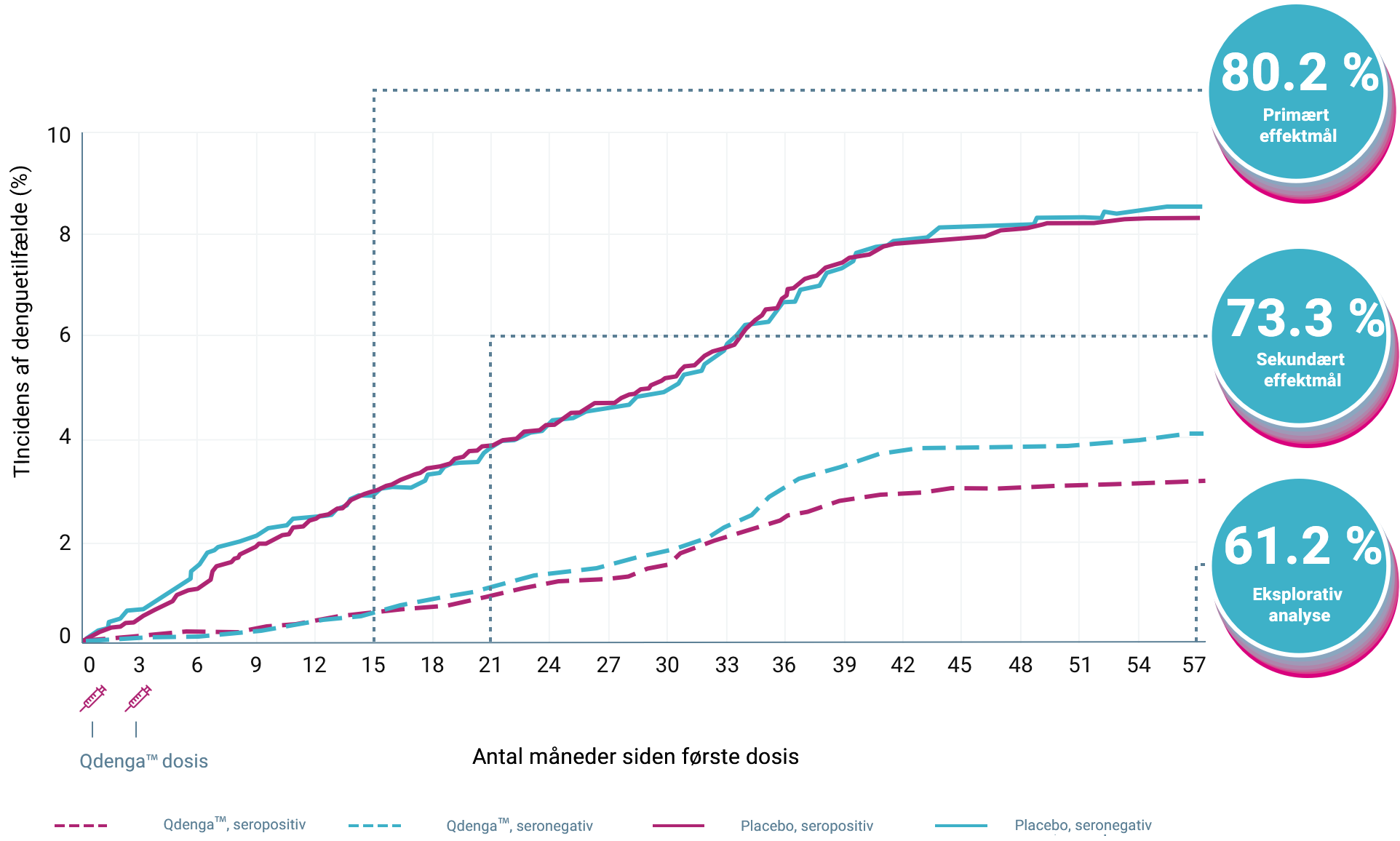
TIDES: QdengaTM forebyggede virologisk bekræftet dengue (VCD) 1-4
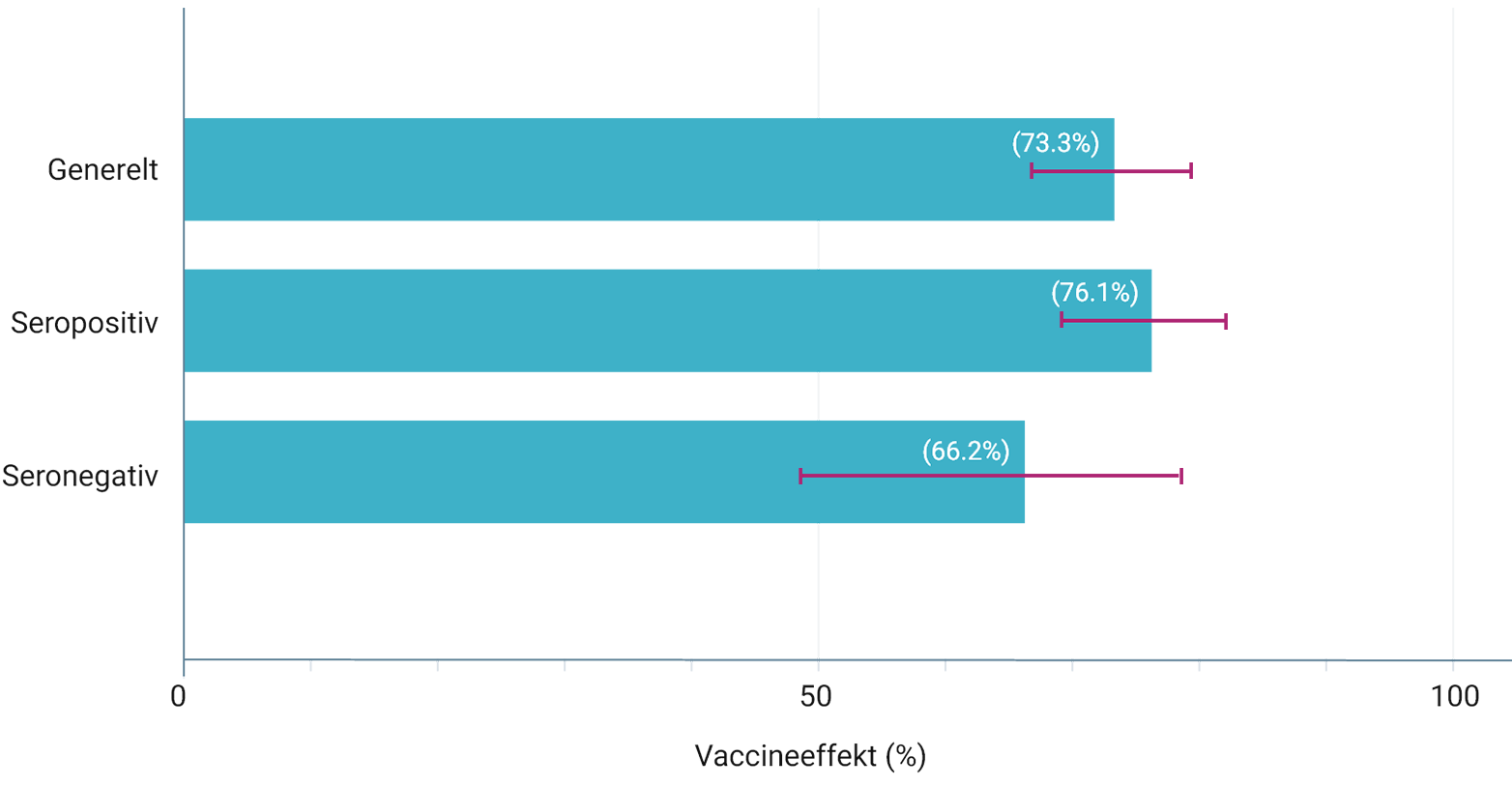
Tides opnåede sit primære effektmål: QdengaTM viste 80,2% generel vaccineeffekt til forebyggelse af VCD forårsaget af enhver af de fire denguevirus serotyper 1-12 måneder efter anden dosis (95%-KI: 73,3-85,3%, p < 0,001) 1,2
61/12.700 VCD-tilfælde i QdengaTM-gruppen vs. 149/6,316 tilfælde i placebogruppen 1,2
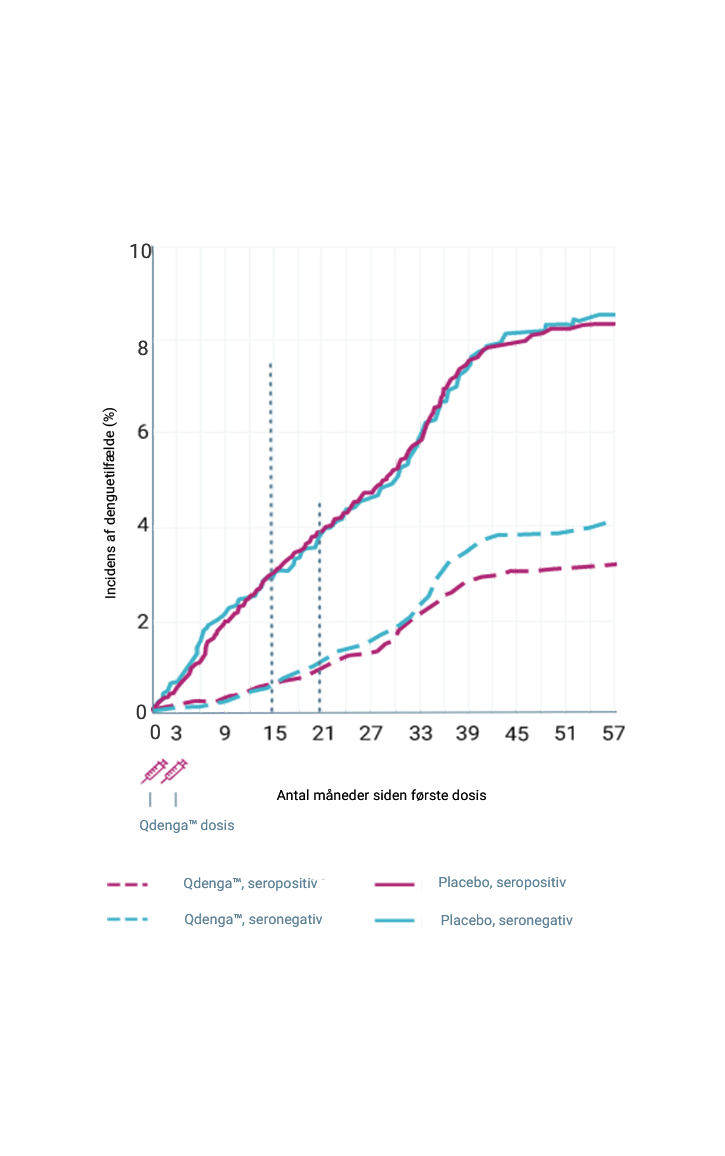
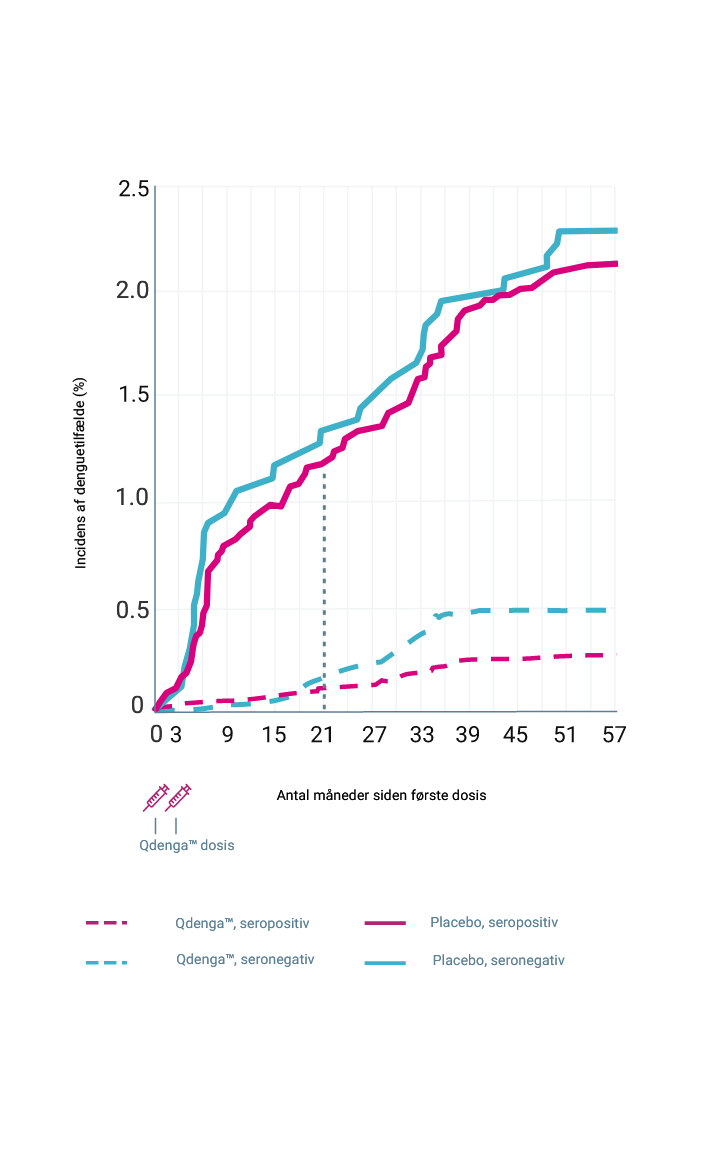
Den kumulative incidens af VCD-tilfælde iht. serostatus ved baseline 2-4
Primære og sekundære effektmål blev analyseret i per-protokol-populationen; kumulativ incidens og eksplorative evalueringer var baseret på data fra safety populationen 1
KI = konfidensinterval, VCD = virologisk bekræftet dengue
Plus icon
denguefeber i europa|close
Vaccinens generelle effekt 1-12 måneder efter anden dosis (95 %-KI: 73,3-85,3 %, p < 0,001) 1,2
61/12.700 VCD-tilfælde i QdengaTM-gruppen vs. 149/6.316 tilfælde i placebogruppen 1,2
Plus icon
denguefeber i europa|close
Vaccinens generelle effekt 1-18 måneder efter anden dosis (95 %-KI: 66,5-78,8 %) 1,3
114/12.700 denguetilfælde i QdengaTM-gruppen vs. 206/6.316 tilfælde i placebogruppen 1,3
Plus icon
denguefeber i europa|close
Vaccinens generelle effekt fra første dosis til 54 måneder efter anden dosis (95 %-KI: 56,0-65,8 %) 1,4
442/13.380 denguetilfælde i QdengaTM-gruppen vs. 547/6.687 tilfælde i placebogruppen 4
denguefeber i europa|close
Vaccineeffekt fra 1 måned til 12 måneder efter den anden dosis (95 % CI: 73,3 %–85,3 %, p<0.001). 2
61/12.700 VCD tilfælde i QdengaTM-gruppen vs. 149/6.316 tilfælde i placebogruppen
Plus icon
denguefeber i europa|close
Vaccineeffekt fra 1 måned til 18 måneder efter den anden dosis (95 % CI: 66,5 %–78,8 %). 3
114/12.700 denguetilfælde i QdengaTM-gruppen vs. 206/6.316 tilfælde i placebogruppen
Uddybende Analyse
denguefeber i europa|close
Vaccineeffekt fra den første dosis til 54 måneder efter den anden dosis (95 % CI: 56,0 %–65,8 %) 1,4
442/13.380 denguetilfælde i QdengaTM-gruppen vs. 547/6.687 tilfælde i placebogruppen
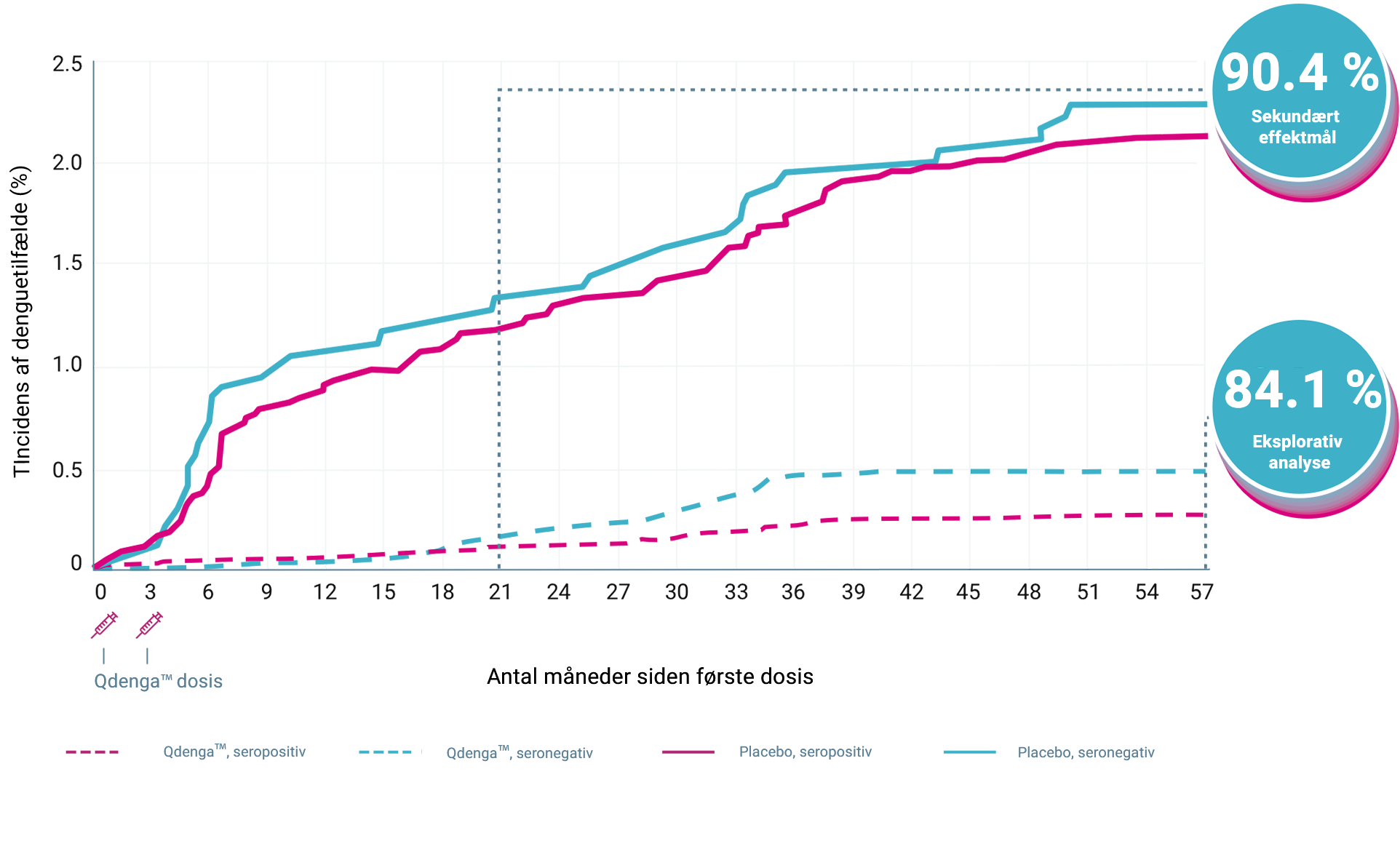
QdengaTM reducerede antallet af indlæggelser som følge af VCD-feber 1-4
Det vigtigste sekundære effektmål i TIDES blev opfyldt: QdengaTM viste en generel vaccineeffekt på 90,4% i forhold til at reducere antallet af indlæggelser som følge af VCD-feber forårsaget af enhver af de fire denguevirus serotyper 1-18 måneder efter anden dosis (95%-KI: 82,6-94,7%, p < 0,001) 1,3
Kumulativ incidens af indlagte VCD-tilfælde* iht. serostatus ved baseline 3,4
Plus icon
denguefeber i europa|close
1-18 måneder efter anden dosis (95 %-KI: 82,6-94,7 %, p < 0,001) 1,3
13/12.700 indlagte tilfælde i QdengaTM-gruppen vs. 66/6.316 i placebogruppen 1,3
Plus icon
denguefeber i europa|close
Fra første dosis til 54 måneder efter anden dosis (95 %-KI: 77,8-88,6 %) 1,4
46/13.380 denguetilfælde i QdengaTM-gruppen vs. 142/6.687 tilfælde i placebogruppen 4
Plus icon
denguefeber i europa|close
90,1 % reduceret antal indlæggelser i Latinamerika (95 %-KI: 15,3-98,8 %) 3
1/6.806 indlagte tilfælde i QdengaTM-gruppen vs. 5/3.374 tilfælde i placebogruppen 1-18 måneder efter anden dosis 3
Uddybende analyse
denguefeber i europa|close
From first dose to 54 months after the second dose (95% CI: 77.8%–88.6%) 1,4
46/13.380 tilfælde i QdengaTM-gruppen vs. 142/6.687 tilfælde i placebogruppen 4
*Der var ikke defineret specifikke kriterier for indlæggelse i forsøgsprotokollen; deltagerne blev indlagt i henhold til de enkelte forskeres vurdering 3
Primære og sekundære effektmål blev analyseret i per-protokol-populationen; kumulativ incidens og eksplorative evalueringer var baseret på safety set data 1
90,1% reduktion i antal indlæggelser i Latinamerika
(95%-KI: 15,3-98,8%) 3
1/6.806 indlagte tilfælde i QdengaTM-gruppen vs. 5/3.374 tilfælde i placebogruppen 1-18 måneder efter anden dosis 3
90,4% reduktion i antal indlæggelser i Asien-Stillehavsområdet
(95%-KI: 82,2-94,8%) 3
12/5.894 indlagte tilfælde i QdengaTM-gruppen vs. 61/2.942 tilfælde i placebogruppen 1-18 måneder efter anden dosis 3
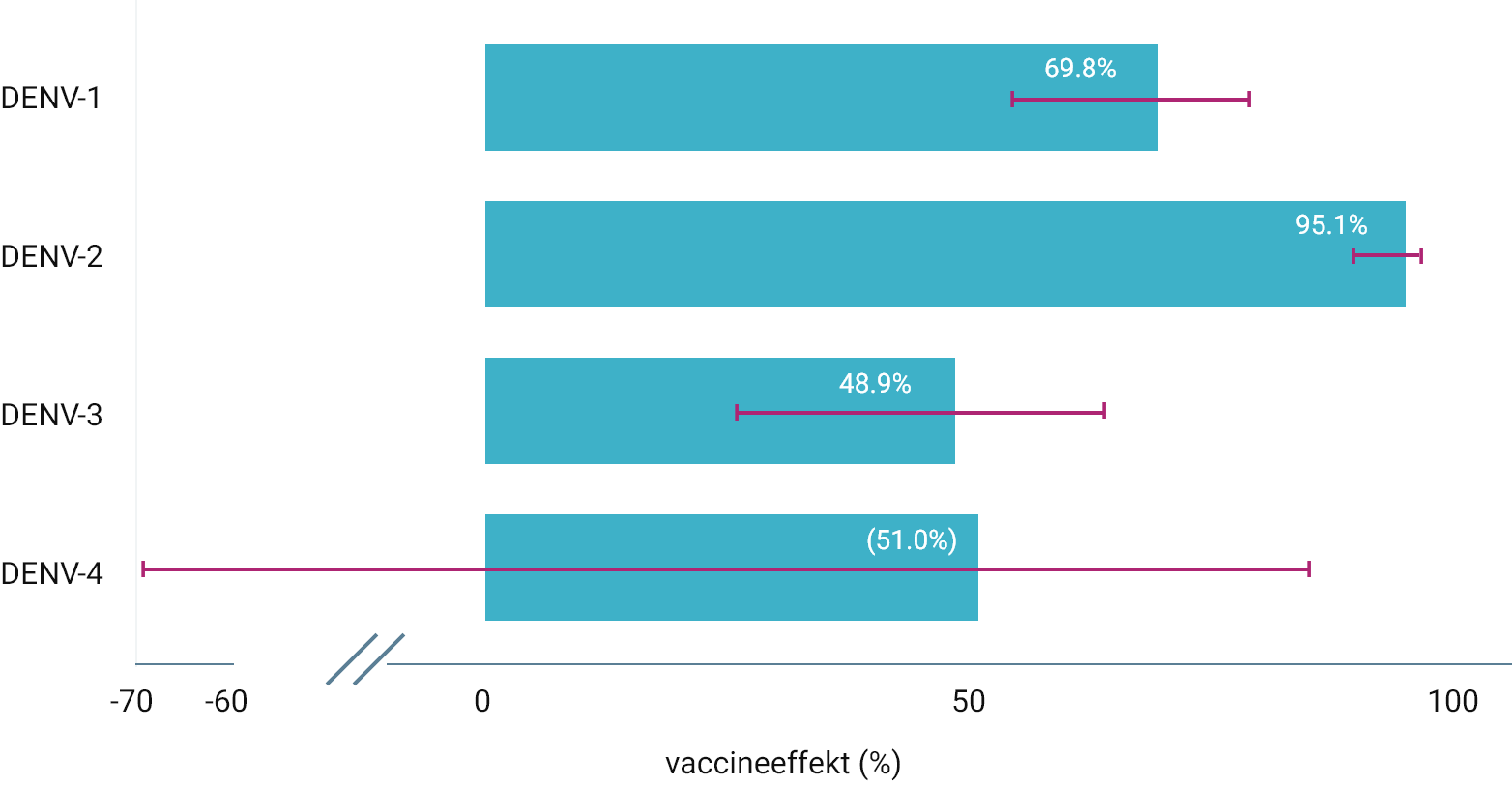
Effekten af QdengaTM iht. serostatus, dengueserotype og sværhedsgrad
EFFEKTEN AF QDENGATM TIL FOREBYGGELSE AF VCD-FEBER 1-18 MÅNEDER EFTER ANDEN DOSIS (SEKUNDÆRT EFFEKTMÅl) 3
Close

Eksplorativ analyse
Eksplorativ analyse viste en effektivitet mod DENV-1 på 72,0% (seropositive, 95%-KI: 52,2-83,6%) og 67,8% (seronegative, 95%-KI: 40,3-82,6%) og mod DENV-2 på 93,7% (seropositive, 95%-KI: 86,1-97,1%) og 98,1% (seronegative, 95%-KI: 85,8-99,7%); effektiviteten var den samme uanset serostatus ved baseline 3
Der kunne ikke udføres analyse for DENV-4, da kun én person var seronegativ ved baseline. Effektiviteten mod DENV-3 varierede alt efter serostatus ved baseline: 61,8% (seropositive, 95%-KI: 43,0-74,4%) og 68,2% (seronegative, 95%-KI: -318,9 til 32,4%); vaccinens effektivitet blev ikke påvist hos personer, der var seronegative 3
VACCINEEFFEKT AF QDENGATM TIL FOREBYGGELSE AF VCD FRA 1 MÅNED TIL 18 MÅNEDER EFTER DEN ANDEN DOSIS (SEKUNDÆRT ENDEPUNKT) 3
Plus icon
Sværhedsgrad
denguefeber i europa|close
Sværhedsgrad 3
Plus icon
Sværhedsgrad
denguefeber i europa|close
Sværhedsgrad 3
To sekundære effektmål blev ikke opfyldt, primært pga. et lille antal tilfælde: 3
- Effekt mod dengueserotype 4
- Effekt mod svær VCD (iht. DCAC-kriterierne)
Aktuelle data tyder på manglende effekt mod DENV-3-infektion hos seronegative deltagere ved baseline, men der er ingen evidens for sygdomsforværring 1,3
Effekten af QdengaTM hos personer over 17 år
Den kliniske effekt af QdengaTM hos personer i alderen 17 år og derover er baseret på bridging af immunogenicitetsdata 1
- Immunogeniciteten af QdengaTM hos voksne i alderen 18-60 år blev vurderet i DENV-304-studiet, et dobbeltblindet, randomiseret, placebokontrolleret fase 3-studie, som blev gennemført i et ikkeendemisk land (USA) 1
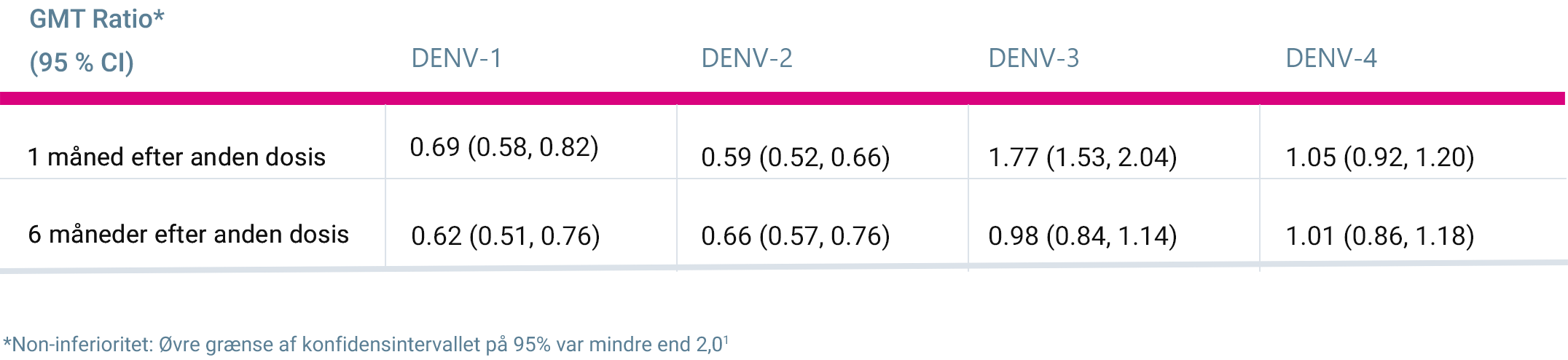
- Bridging af effekt er baseret på immunogenicitetsdata og resultater fra en noninferioritetsanalyse, der sammenligner GMT'er efter vaccination hos dengue-seronegative populationer ved baseline i TIDES og DEN-304 1
- Der forventes beskyttelse mod denguefeber hos voksne, selv om den faktiske effektstørrelse i forhold til den, der observeres hos børn og unge, er ukendt 1
GMT-ratio mellem seronegative deltagere ved baseline i TIDES (4-16 år) og DENV-304 (18-60 år) (per-protokol-sæt for immunogenicitet) 1

Immunogenicitet
I TIDES FORBLEV SEROPOSITIVITETSRATERNE MOD ALLE FIRE DENGUEVIRUS SEROTYPER PÅ OVER 90% OP TIL 15 MÅNEDER EFTER FØRSTE DOSIS QDENGATM 3
Seropositivitetsrater iht. dengueserotype *,3
De fremlagte seropositivitetsdata påviser ikke klinisk effekt og dokumenterer ikke beskyttelse mod dengue
Procentdel af evaluerede deltagere (%)
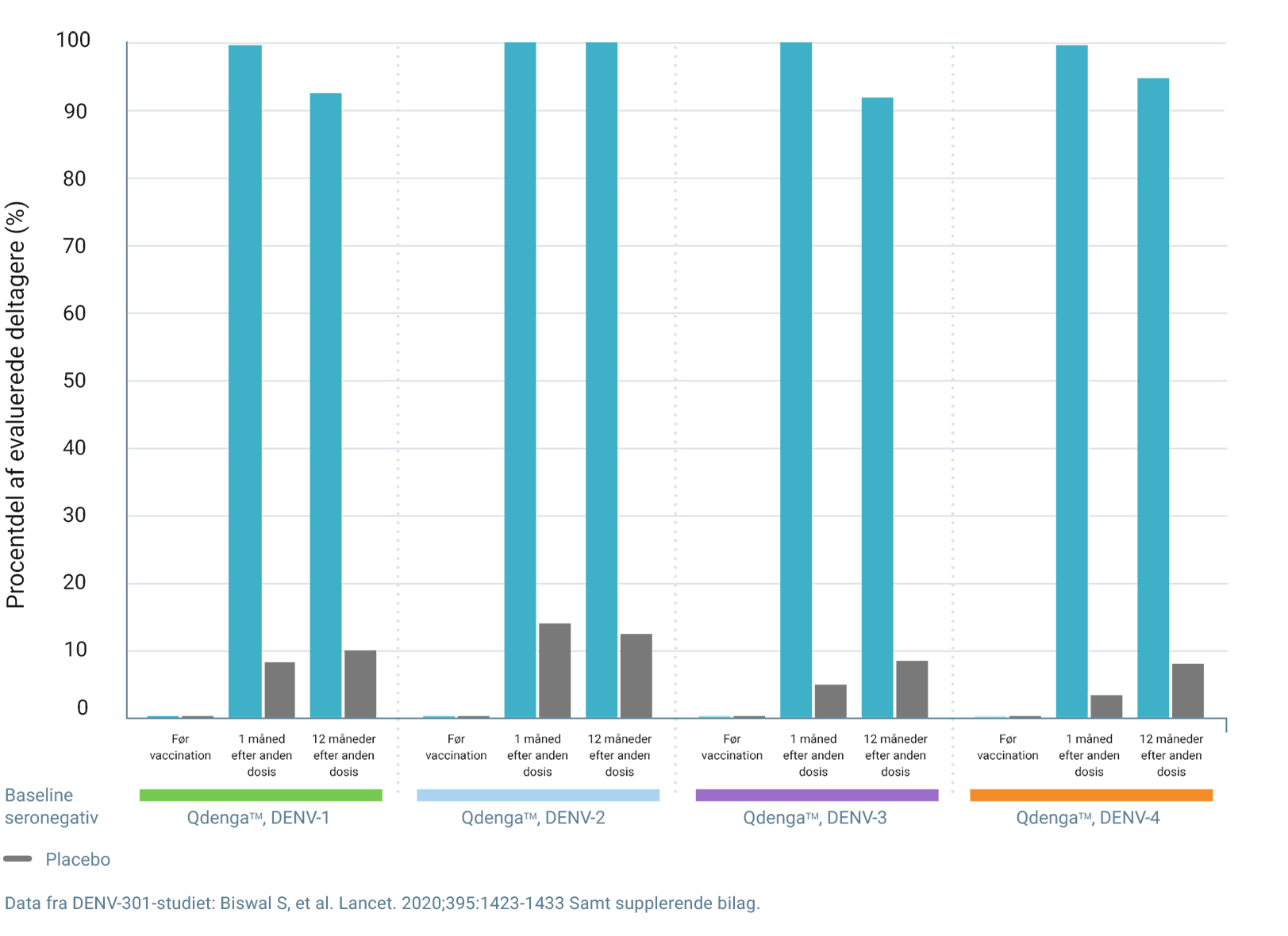
Én måned efter anden dosis var raterne for tetravalent seropositivitet: 3
- 99,5% hos baseline-seronegative individer (vs. 3,5% for placebo)
I FORSØGET TIDES FORBLEV SEROPOSITIVITETSRATEN MOD ALLE FIRE DENGUE SEROTYPER OVER 90% OP TIL 15 MÅNEDER EFTER DEN FØRSTE DOSIS AF QDENGATM 2
Seropositivitetsraten af dengue serotype * 3
Den præsenterede data for seropositivitet viser ikke klinisk effekt og indikerer ikke beskyttelse mod denguefeber
Procent af evaluerede forsøgsdeltagere (%)
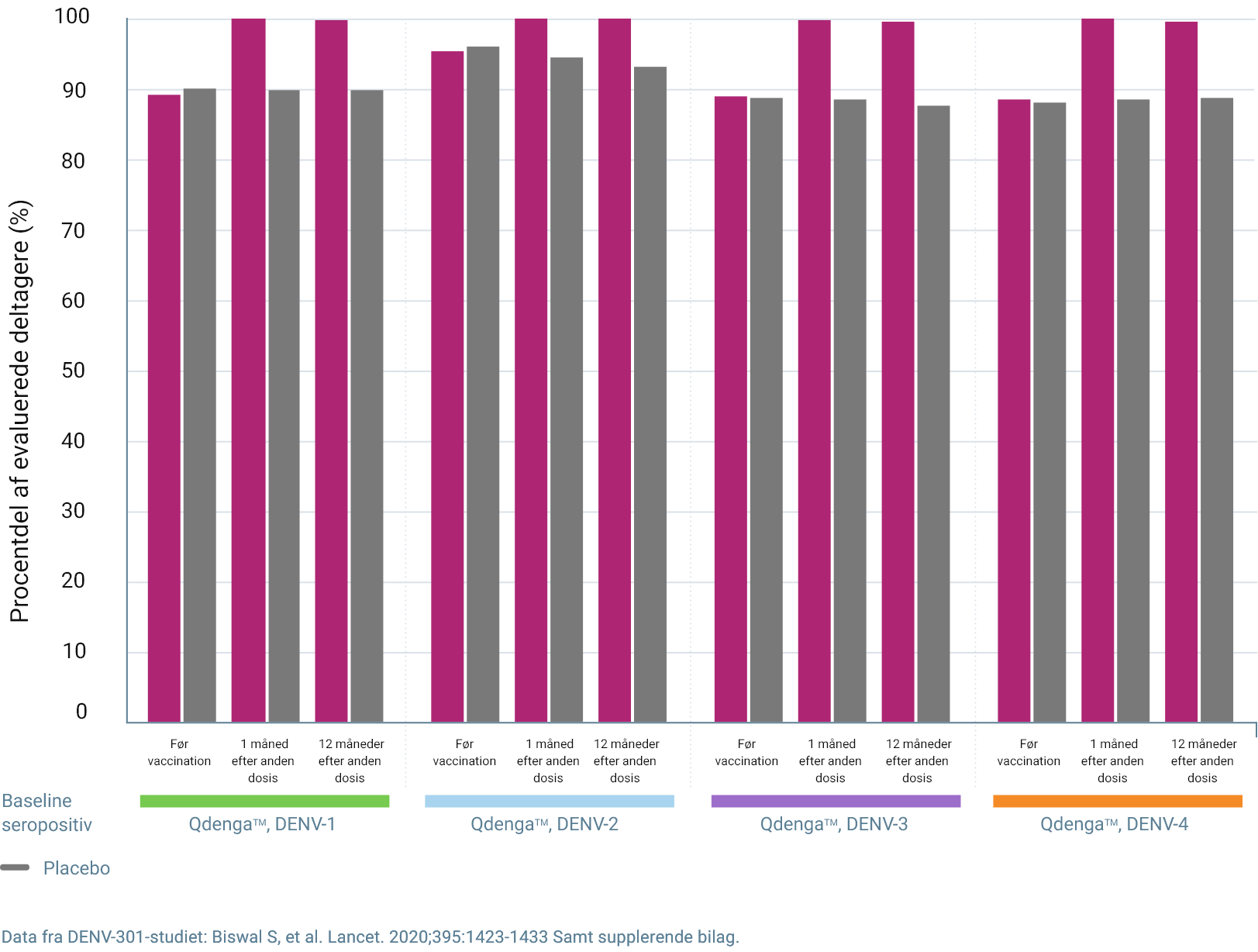
Data fra forsøg DENV-301: Biswal S, et al. Lancet. 2020;395:1423-1433 and supplementary appendix.
Én måned efter anden dosis var raterne for tetravalent seropositivitet: 3
- 99,8% hos baseline-seropositive individer (vs. 85,2% for placebo)
*Per-protokol-sæt for immunogenicitetsdata. Seropositiv defineres som en reciprok titer af neutraliserende antistoffer ≥ 10. Seronegativ ved baseline defineres som seronegativ for alle fire denguevirus serotyper. Seropositiv ved baseline defineres som seropositiv for en eller flere serotyper. 3
Bivirkningsprofil
TIDES: Vurdering af virkningen ved tetravalent immunisering mod dengue hos raske børn 2,3
Til dato har QdengaTM generelt været veltolereret i TIDES 1,4
- Der er ikke observeret væsentlige risici i TIDES op til 4,5 år efter anden dosis QdengaTM 1,4
- Der sås en sammenlignelig kumulativ incidens af alvorlige bivirkninger hos individer i behandling med QdengaTM og placebo 3
- Op til 18 måneder efter anden dosis: hhv. 4,0% og 4,8%
- Konsistent med de forventede medicinske sygdomme i studiepopulationen
- Der er ingen evidens for, at QdengaTM forstærkede sygdommens sværhedsgrad hos seronegative individer 1,3
- Forekomsten af alvorlige bivirkninger var 4,3% hos både seropositive (624/14.520) og seronegative individer (238/5.547) op til 18 måneder efter anden dosis
Overblik over alvorlige bivirkninger iht. bivirkningsdata i TIDES* 1-18 måneder efter anden dosis QdengaTM 3
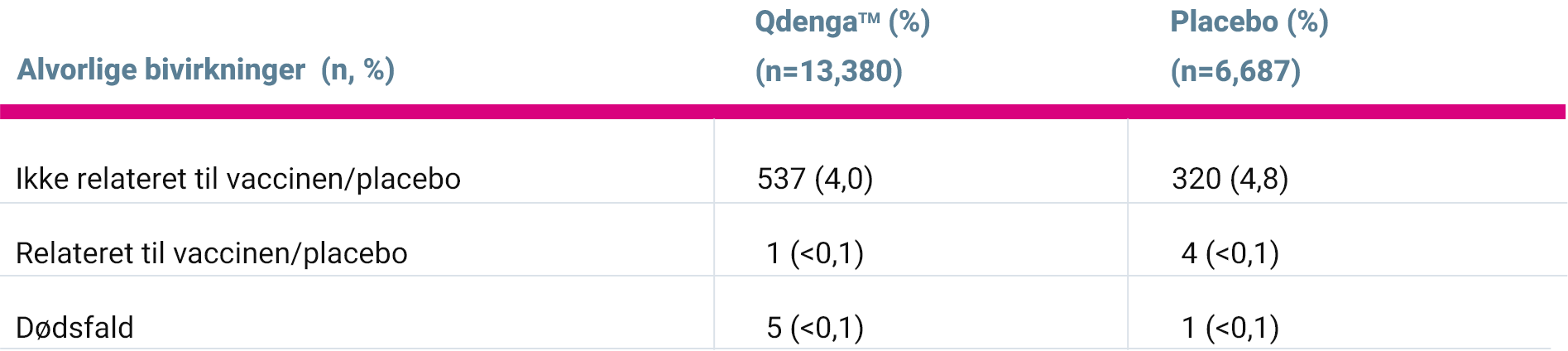

Investigatorer, sponsor og datamonitoreringsudvalget vurderede, at ingen af dødsfaldene var relateret til QdengaTM eller forsøgsprocedurerne: Aseptisk meningitis, arteriovenøs malformation anaplastisk ependymom, skudsår, kvælning og trafikulykke. 3
Overblik over alvorlige bivirkninger iht. bivirkningsdata i TIDES* 19-54 måneder efter anden dosis QdengaTM 4


* Som vurderet af investigator 3
Generel klinisk sikkerhed ved QdengaTM
Den generelle bivirkningsprofil for QdengaTM er baseret på en stratificeret analyse, der omfatter seronegative individer, i alt 14.627 deltagere i alderen 4-60 år (13.839 børn og 788 voksne), der er blevet vaccineret med QdengaTM, herunder en undergruppe på 3.830 deltagere (3.042 børn og 788 voksne), hvor der er set reaktogenicitet 1
- De hyppigste bivirkninger i de kliniske forsøg var milde til moderate og af kort varighed (1-3 dage) 1
- De hyppigst rapporterede bivirkninger hos deltagere i alderen 4-60 år var smerter ved injektionsstedet, hovedpine, myalgi, erytem ved injektionsstedet, utilpashed, asteni og feber 1
- Bivirkningerne var mindre hyppige efter anden injektion end efter første injektion 1
- Bivirkningerne hos børn havde samme hyppighed og var af samme type og sværhedsgrad som hos voksne 1
- QdengaTM påvirker i mindre grad evnen til at føre motorkøretøj og betjene maskiner 1
- I ét klinisk studie (DEN-205) sås forbigående vaccinerelateret viræmi, som var forbundet med milde til moderate symptomer af en gennemsnitlig varighed på 4 dage; dette sås kun i sjældne tilfælde efter anden dosis QdengaTM 1
- I produktinformationen findes den fulde bivirkningsprofil, særlige advarsler og forsigtighedsregler samt kontraindikationer for brug af QdengaTM
Bivirkninger set i kliniske forsøg (4-60 år) 1
Bivirkningernes hyppighed defineres som følger: Meget almindelig (≥ 1/10), almindelig (≥ 1/100 til < 1/10), ikke almindelig (≥ 1/1000 til < 1/100), sjælden (≥ 1/10.000 til < 1/1.000) og meget sjælden (< 1/10.000) 1
| Symptomernes placering | Hyppighed | Bivirkninger | ||||||
|---|---|---|---|---|---|---|---|---|
| Infektioner og parasitære sygdomme | Meget almindelig |
|
||||||
| Almindelig |
|
|||||||
| Ikke almindelig |
|
|||||||
| Metabolisme og ernæring | Meget almindelig |
|
||||||
| Psykiske forstyrrelser | Meget almindelig |
|
||||||
| Nervesystemet | Meget almindelig |
|
||||||
| Ikke almindelig |
|
|||||||
| Mave-tarm-kanalen | Ikke almindelig |
|
||||||
| Hud og subkutane væv | Ikke almindelig |
|
||||||
| Meget sjælden |
|
|||||||
| Knogler, led, muskler og bindevæv | Meget almindelig |
|
||||||
| Ikke almindelig |
|
|||||||
| Almene symptomer og reaktioner på administrationsstedet | Meget almindelig |
|
||||||
| Almindelig |
|
|||||||
| Ikke almindelig |
|
a Omfatter infektion i de øvre luftveje og virusinfektion i de øvre luftveje
b Omfatter faryngotonsillitis og tonsillitis
c Indsamlet hos børn under 6 år i kliniske forsøg
d Omfatter udslæt, viralt udslæt, makulopapuløst udslæt, kløende udslæt
e Rapporteret hos voksne i kliniske forsøg
- [SPC] Produktresumé for QdengaTM
- [BIS19] Biswal S, et al. N Engl J Med. 2019;381(21):2009-2019 and supplementary appendix.
- [BIS20] Biswal S, et al. Lancet. 2020;395:1423-1433 and supplementary appendix.
- [TRI22] Tricou V, et al. Efficacy and Safety of Takeda’s Tetravalent Dengue Vaccine Candidate (TAK-003) After 4.5 Years of Follow-Up. Fremlagt ved: 44th ICMM World Congress on Military Medicine, 5.-9. september 2022, Bruxelles, Belgien.
- [CT1] Takeda. Lot-to-lot consistency of 3 lots of tetravalent dengue vaccine (TDV) in non-endemic country(ies) for dengue. ClinicalTrials.gov Identifier: NCT03423173. Opdateret 20. oktober 2020. Tilgået 12. oktober 2022.
https://clinicaltrials.gov/ct2/show/study/NCT03423173 - [CT2] Takeda. Immunogenicity and safety of tetravalent dengue vaccine (TDV) at the end of shelf life in healthy adults. ClinicalTrials.gov Identifier: NCT03771963. Opdateret 7. juni 2021. Tilgået 12. oktober 2022.
https://clinicaltrials.gov/ct2/show/NCT03771963 - [CT3] Takeda. Immunogenicity and safety of dengue tetravalent vaccine (TDV) and recombinant 9-valent human papillomavirus vaccine (9vHPV) in participants aged ≥9 to <15 years. ClinicalTrials.gov Identifier: NCT04313244. Opdateret 25. juli 2022. Tilgået 12. oktober 2022.
https://clinicaltrials.gov/ct2/show/NCT04313244 - [CT4] Takeda. Immunogenicity and safety of tetravalent dengue vaccine (TDV) co-administered with an hepatitis A virus vaccine. ClinicalTrials.gov Identifier: NCT03525119. Opdateret 19. august 2022. Tilgået 12. oktober 2022.
https://clinicaltrials.gov/ct2/show/NCT03525119 - [CT5] Takeda. Immunogenicity and safety of tetravalent dengue vaccine (TDV) in adolescents in non-endemic area(s). ClinicalTrials.gov Identifier: NCT03341637. Opdateret 15. august 2019. Tilgået 12. oktober 2022.
https://clinicaltrials.gov/ct2/show/NCT03341637 - [CT6] Takeda. Immunogenicity and safety of tetravalent dengue vaccine (TDV) administered with a yellow fever vaccine in adults. ClinicalTrials.gov Identifier: NCT03342898. Opdateret 8. oktober 2020. Tilgået 12. oktober 2022.
https://clinicaltrials.gov/ct2/show/NCT03342898 - [CT7] Takeda. Safety and immunogenicity of Takeda's tetravalent dengue vaccine (TDV) in healthy children. ClinicalTrials.gov Identifier: NCT02948829. Opdateret 25. juli 2022. Tilgået 12. oktober 2022.
https://clinicaltrials.gov/ct2/show/NCT02948829 - [CT8] Takeda. Efficacy, Safety and Immunogenicity of Takeda's Tetravalent Dengue Vaccine (TDV) in Healthy Children (TIDES). ClinicalTrials.gov Identifier: NCT02747927. Opdateret 1. august 2022. Tilgået 12. oktober 2022.
https://clinicaltrials.gov/ct2/show/NCT02747927 - [CT9] Takeda. Safety and immunogenicity with two different serotype 2 potencies of Takeda's tetravalent dengue vaccine candidate (TDV) in adults in Singapore. ClinicalTrials.gov Identifier: NCT02425098. Opdateret 28. august 2019. Tilgået 12. oktober 2022.
https://clinicaltrials.gov/ct2/show/NCT02425098 - [CT10] Takeda. Immunogenicity and safety of tetravalent dengue vaccine candidate (TDV) in flavivirus-naïve and dengue-immune adults. ClinicalTrials.gov Identifier: NCT03746015. Opdateret 25. februar 2022. Tilgået 12. oktober 2022.
https://clinicaltrials.gov/ct2/show/NCT03746015 - [CT11] Takeda. Safety and immunogenicity of different schedules of Takeda's tetravalent dengue vaccine candidate (TDV) in healthy participants. ClinicalTrials.gov Identifier: NCT02302066. Opdateret 24. februar 2020. Tilgået 12. oktober 2022.
https://clinicaltrials.gov/ct2/show/NCT02302066 - [CT12] Takeda. Long-term safety and antibody persistence of TDV and the impact of a booster dose. ClinicalTrials.gov Identifier: NCT03999996. Opdateret 17. november 2021. Tilgået 12. oktober 2022.
https://clinicaltrials.gov/ct2/show/NCT03999996 - [CT13] Takeda. Study to investigate the safety and immunogenicity of a tetravalent chimeric dengue vaccine in healthy volunteers between the ages of 1.5 - 45 years. ClinicalTrials.gov Identifier: NCT01511250. Opdateret 18. juli 2019. Tilgået 12. oktober 2022.
https://clinicaltrials.gov/ct2/show/NCT01511250 - [CT14] Takeda. Safety and immunogenicity of three formulations of Takeda's tetravalent dengue vaccine candidate (TDV). ClinicalTrials.gov Identifier: NCT02193087. Opdateret 18. juli 2019. Tilgået 12. oktober 2022.
https://clinicaltrials.gov/ct2/show/NCT02193087 - [CT15] Takeda. Impact of SC vs IM administration of DENVax (TDV) on safety and immunogenicity. ClinicalTrials.gov Identifier: NCT01728792. Opdateret 18. juli 2019. Tilgået 12. oktober 2022.
https://clinicaltrials.gov/ct2/show/NCT01728792 - [CT16] Takeda. A comparison of the safety and immunogenicity of various schedules of dengue vaccine in healthy adult volunteers. ClinicalTrials.gov Identifier: NCT01542632. Opdateret 18. juli 2019. Tilgået 12. oktober 2022.
https://clinicaltrials.gov/ct2/show/NCT01542632 - [CT17] Takeda. Phase 1b study investigating safety & immunogenicity of TDV given intradermally by needle or needle-free PharmaJet Injector. ClinicalTrials.gov Identifier: NCT01765426. Opdateret 18. juli 2019. Tilgået 12. oktober 2022.
https://clinicaltrials.gov/ct2/show/NCT01765426 - [CT18] Takeda. Safety and immunogenicity study to assess TDV, a live attenuated tetravalent vaccine for prevention of dengue fever. ClinicalTrials.gov Identifier: NCT01224639. Opdateret 19. juni 2018. Tilgået 12. oktober 2022.
https://clinicaltrials.gov/ct2/show/NCT01224639

